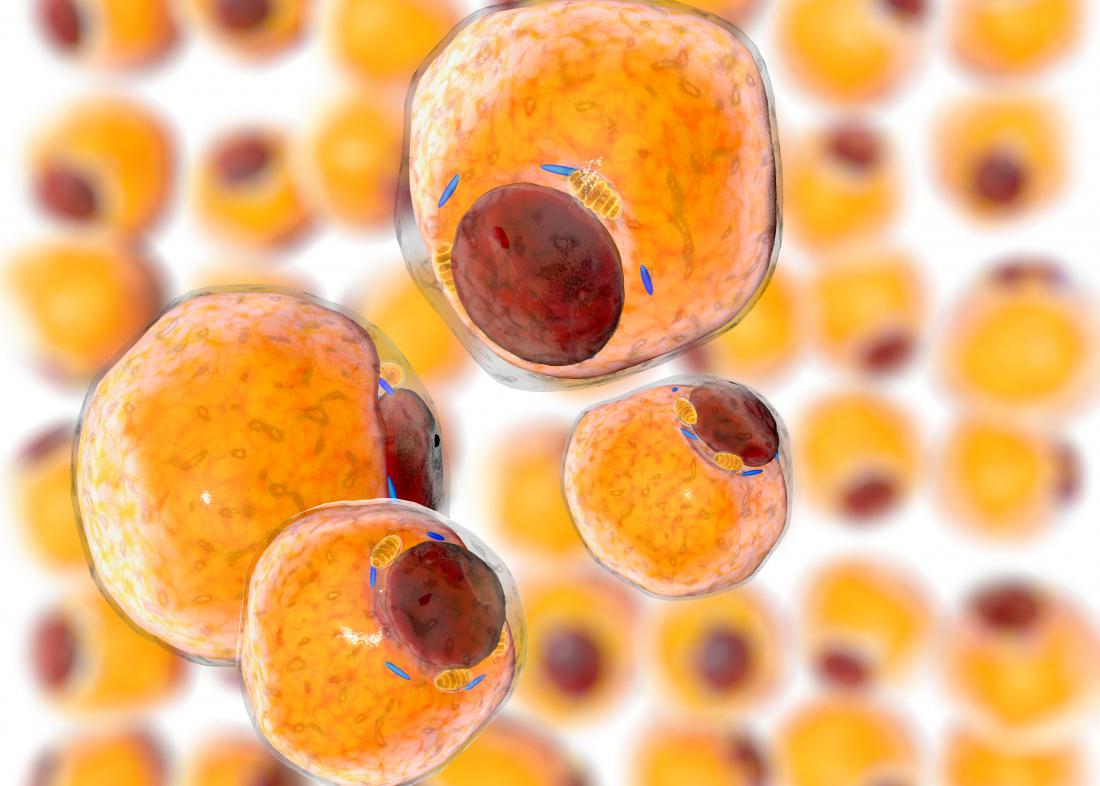
Kanser hücreleri sürekli olarak büyür ve bölünür, bu da tutarlı bir enerji kaynağına ihtiyaç duydukları anlamına gelir. Yeni bir çalışma, kanserin yağ hücrelerinden nasıl yakıt aldığını incelemekte ve tümörün beslenmesini açacak potansiyel bir mekanizma bulmaktadır.
Kanser, araştırıcıların aklına gelen her algılanan açı ile birlikte, giderek karmaşıklaşan bir çalışma alanıdır.
Bununla birlikte, milyonlarca saatlik deneyime rağmen, hala yanıtlanmamış birçok soru var.
Kanser hakkında daha fazla şey öğrendikçe, tüm vücut hastalığı olarak ele alınması gerektiği giderek daha net hale gelir.
Kanserin hayatta kalması ve gelişmesi için, vücudun hücrelerinden ve dokularından enerji çekmesi, dolaşım sistemini kullanması ve bağışıklık sisteminden kaçınması gerekir. Tümörler büyümelerini sürdürmek ve vücutta bütünleşmek için akıllıca çalışmalıdır.
Araştırmacılar şimdi sadece kanserli hücrelere değil, aynı zamanda tümörlerin onları desteklemek için güvendiği sistemlere de saldırmaya odaklanıyor.
Tümör, metabolizma ve yağ
San Diego, CA’daki Sanford Prebys Medical Discovery Institute’dan araştırmacılar, özellikle tümörlerin yağ hücreleriyle iletişim kurma biçimleriyle ilgileniyorlar. Eş-kıdemli çalışma yazarı Maria Diaz-Meco, Ph.D., daha fazla açıklıyor.
“Daha iyi bilinen genetiğin ötesindeki kanser terapötiğinin diğer yönlerini” göz önüne almalıyız. ”Yani, ortak olması gereken metabolik zafiyetlerin tanımlanmasıyla ilgilenen kanser metabolizmasının araştırılmasına daha fazla yatırım yapmamız gerekiyor. her türlü kansere. “
Bu soruşturma hattı hayati. Diaz-Meco’nun devam ettiği gibi, “Bu sonuçta, onkojen-hedef yaklaşımlarında çok yaygın bir sorun olan dirençlere karşı daha az duyarlı olan daha iyi terapilere yol açacaktır.”
Amerika Birleşik Devletleri’nde prostat kanseri, erkekler arasında kansere bağlı ölümlerin ikinci önde gelen nedenidir. Obezite, önemli bir risk faktörü olarak bilinir ve kanserin ne kadar agresif davranacağını tahmin eder. Ancak tam olarak obezitenin prostat kanseri sonuçlarını nasıl kötüleştirdiği henüz bilinmemektedir.
Bugüne kadar, obezite ve prostat kanserini araştıran birçok çalışma, yüksek yağlı bir diyetle beslenen farelere odaklanmıştır. Eş-kıdemli çalışma yazarı Jorge Moscat, Ph.D., bunun neden ideal olmadığını açıklıyor.
“Bu, hastalardaki bazı durumları taklit etse de,” diyor, “tümörler ve adipositler veya yağ hücreleri arasındaki çift yönlü iletişimi kontrol eden sinyal yollarının gerçek anlamda anlaşılmasını engelliyor.”
“Bu zorunludur” diye ekliyor Moscat, “adipoz dokudan yayılan pro-tümörjenik sinyalleri önlemek için kullanılabilecek tedavi hedeflerini belirlemek istiyorsak.”
Moscat ve Diaz-Meco bu soruna yeni bir yönden yaklaştılar: yağ hücrelerinde p62 olarak bilinen özel bir proteinden yoksun bir fare modeli kullandılar. Bu proteinde eksik olan fareler standart bir diyetle beslendiklerinde bile obez olurlar.
İlginç bulguları günümüzde dergide yayınlanmaktadır.
Tümörler yakıt için yağ hücrelerini kullanır
P62’nin yağ dokusu ve tümörler arasındaki iletişimde önemli bir rol oynadığını bulmuşlardır. Protein, kanserin ilerlemesini ve metastazını teşvik eden “metabolik uygunluğunu” destekliyor gibi görünmektedir. Bunu, mTORC1 olarak adlandırılan ikinci bir proteini inhibe ederek başarır.
MTORC1 bastırıldığında, oksidatif fosforilasyon ve “beyaz yağ dokusunda yağ asidi metabolizması” gibi yağ hücrelerinin enerji tüketen aktiviteleridir. Bu süreçler durdukça, tümörün büyümesi ve gelişmesi için kullanabileceği daha fazla yağ asidi ve diğer besin maddeleri vardır.
“Bu metabolik reprogramda adipositlerdeki p62 kaybıyla orkestralanmış tümörlerin, agresif kanserin yüksek enerjili talepleri ile başa çıkmalarına yardımcı olduğu görülmektedir.”
Maria Diaz-Meco, Ph.D.
Takip deneylerinde, ekip, p62 eksikliğinin, her ikisi de kanser hücrelerinin çoğalmasına ve metastaz yapmasına yardımcı olan Cpt1a ve osteopontin üretimini desteklediğini göstermiştir.
Özellikle agresif, kastrasyona dirençli prostat kanserinde, Cpt1a ve osteopontin daha yüksek seviyelerde bulunur.
Bu bulgular kanserin gelecekteki tedavileri ile ilgili olacaktır. Moscat’ın dediği gibi, “Önemlilik çok büyüktür, çünkü eğer modüle edilirse, aktive edilmiş adipoz dokunun tümör malignitesini ilerletme yeteneğini bloke etmesi gereken yeni bir terapötik hedefler dizisi belirleriz.”
Günümüzde, mTOR inhibitörleri bir dizi kanserin tedavisinde kullanılmaktadır. Araştırmacılar bunun yağ dokusu metabolizmasını kapatabileceğini, ancak bazı durumlarda tümör büyümesini körükleyeceğinden endişe ediyorlar.
Ancak, bunun böyle olup olmadığını teyit etmek için daha fazla çalışmaya ihtiyaç duyulacaktır.